Потемки катализа
Почему химики до сих пор ищут катализаторы на ощупь

В 2003 году американские ученые умудрились провести реакцию кросс-сочетания без обычных для нее катализаторов. Связь между атомами углерода в реакции органического галогенида с бороновой кислотой образовалась, хотя необходимых солей и комплексов палладия химики в реакции не использовали. Ученые были настолько удивлены, что закупили новую стеклянную посуду и организовали для одного из сотрудников лаборатории «карантин»: чтобы никто случайно не занес катализатор на халате, работал с реакцией только он, а в рабочее пространство нельзя было вносить соли переходных металлов, которые могли загрязнить исходные реагенты. Но реакция все равно шла. Только через два года после публикации статьи о «некаталитическом» кросс-сочетании те же химики выяснили, что катализатор в их реакции все же был. Один из реагентов был с примесью палладия — настолько небольшой, что изначально ее обнаружить ученым не удалось.
В 2003 году американские ученые умудрились провести реакцию кросс-сочетания без обычных для нее катализаторов. Связь между атомами углерода в реакции органического галогенида с бороновой кислотой образовалась, хотя необходимых солей и комплексов палладия химики в реакции не использовали. Ученые были настолько удивлены, что закупили новую стеклянную посуду и организовали для одного из сотрудников лаборатории «карантин»: чтобы никто случайно не занес катализатор на халате, работал с реакцией только он, а в рабочее пространство нельзя было вносить соли переходных металлов, которые могли загрязнить исходные реагенты. Но реакция все равно шла. Только через два года после публикации статьи о «некаталитическом» кросс-сочетании те же химики выяснили, что катализатор в их реакции все же был. Один из реагентов был с примесью палладия — настолько небольшой, что изначально ее обнаружить ученым не удалось. И хотя сенсацию отменили, оригинальную статью с публикации никто не снял. Для каталитической химии подобные случаи если не норма, то точно не редкость. Даже журналы высокого уровня иногда публикуют статьи с невоспроизводимыми реакциями. Достоверно известно, что катализатор в системе есть, но что это за вещество и откуда оно там взялось — непонятно (о том, как подобные проблемы портят жизнь психологам и онкобиологам, мы писали в материалах «Не повторяется такое иногда» и «Собака съела протокол»).
Ускоряем реакцию
Катализаторы — химические соединения, которые ускоряют реакции, но не расходуются в них. О том, что такие вещества существуют, химики узнали случайно. Одну из первых каталитических реакций провел сэр Гемфри Дэви в 1817 году. Он изучал воспламеняемость углеводородов, и в одном из экспериментов в качестве переносчика тепла решил использовать платиновую проволоку, устойчивую к высоким температурам.
Дэви заполнил реакционный сосуд с платиновой проволокой смесью воздуха и углеводородов и поджег ее. Как только смесь воспламенилась, ученый добавил в нее еще углеводородов — чтобы проверить, хватит ли накопившегося в реакционной смеси тепла для продолжения реакции. Горение, как он и предполагал, продолжилось.
Но через несколько секунд химик обнаружил, что платиновая проволока разогрелась и стала ярко светиться. Причем, несмотря на недостаток кислорода, горение продолжалось несколько минут даже без подвода тепла.
Если же он сначала заполнял сосуд смесью воздуха и углеводородов и потом вносил туда раскаленную докрасна проволоку, то пламя на ее поверхности не возникало, зато резко повышалась температура проволоки. Из этого Дэви вывел, что реакция идет на поверхности проволоки, а значит именно платина значительно ускоряет окисление. Так, совершенно случайно, был открыт один из первых катализаторов — и каталитические реакции вообще.
За прошедшие два века мы успели неплохо разобраться в том, как вещества, которые не нужны в химической реакции, могут, однако, ее ускорить. Катализатор вносит в обычную последовательность химического превращения новые промежуточные стадии. Например, при кросс-сочетании по Судзуки палладиевый катализатор сначала присоединяется по связи углерод-галоген в галогениде, затем реагирует с бороновой кислотой при содействии основания, а потом возвращается в исходное состояние, при этом от палладия отщепляется продукт кросс-сочетания. Там, где работает катализ, реагенты при встрече становятся чем-то другим не за один шаг, а в несколько стадий, успев побывать не в одном, а в нескольких переходных состояниях. У переходного состояния энергия достигает пика — этот барьер нужно перепрыгнуть, чтобы реакция прошла. Если у реагентов ее недостаточно, реагировать друг с другом они не будут.
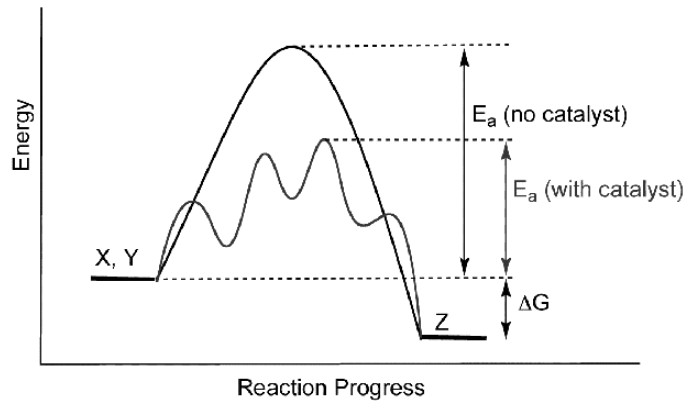
Катализатор реагирует с исходными веществами и превращается в промежуточные соединения. Если он подобран правильно, энергетические барьеры между промежуточными соединениями оказываются ниже, чем в некаталитическом процессе, и реакция идет быстрее. Бывает, что сам по себе энергетический барьер очень высок, и в норме вещества вообще не реагируют друг с другом, но в присутствии катализатора реакция происходит за считанные минуты. При этом в зависимости от катализатора, из одних и тех же исходных веществ могут получаться разные продукты — просто потому, что каждый катализатор по-своему влияет на переходные состояния разных реакций. Например, из смеси двух алкенов с помощью катализатора Циглера — Натта (тетрахлорида титана в смеси с триэтилалюминием) можно получить полимер, а с помощью катализатора Граббса (карбенового комплекса рутения) — продукт реакции метатезиса.
Сам катализатор, после того, как выполнил свою работу, возвращается в исходное состояние. Поэтому даже минимальное количество палладия, попавшее в эксперимент американских химиков, раз за разом запускало реакцию кросс-сочетания. Впрочем, катализаторы часто сами вступают в необратимые побочные химические превращения — с продуктами, следами воды и воздуха, стенками посуды, даже сами с собой. Из-за этого они теряют активность, и на практике большинство катализаторов все-таки расходуются — их просто не выделяют из итоговой смеси после завершения реакции.
