Что происходит с яйцом в кипятке

В кипящей воде яичный белок из жидкого и прозрачного становится твёрдым и белым — мы говорим, что яйцо свернулось, или белок свернулся. На самом деле это не совсем так. С точки зрения того, как устроены молекулы белков, все они в той или иной мере свернувшиеся: и сырой яичный альбумин*, и гемоглобин в крови, и пищеварительные ферменты, и кератины, из которых состоят волосы и ногти, и т. д. При варке же яичные белки разворачиваются, из-за чего яйцо твердеет и белеет. С физико-химической точки зрения этот процесс лучше называть не сворачиванием, а денатурацией.
* Доля собственно белков в яичном белке составляет около 10%. Больше половины из них приходится на яичный альбумин, или овальбумин.
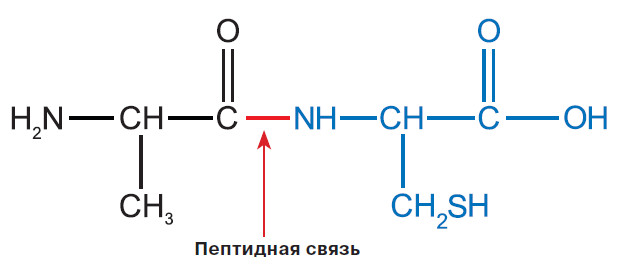
Чтобы понять, что имеется в виду, нужно вспомнить, как устроены белки. Любой белок — это более или менее длинная цепочка двадцати аминокислот. В аминокислотах есть атомы, которыми они соединяются друг с другом, образуя длинный остов полипептидной цепи. И есть атомы, точнее, группы атомов, которые торчат в сторону от этого длинного остова. Их называют боковыми радикалами, боковыми цепями или боковыми группировками. У каждой аминокислоты они свои. Боковой радикал определяет свойства аминокислоты. Например, у многих аминокислот в нём есть атомы азота, кислорода или серы, притягивающие к себе электроны и приобретающие таким образом частично отрицательный заряд. Поскольку на них больше концентрируется отрицательный электрический заряд, с ними легко образуют связь молекулы, в которых есть что-то положительно заряженное, например молекулы воды, — их атомы водорода несут тот самый частично положительный заряд. Такие молекулы или их фрагменты, где можно выделить условные «плюс» или «минус», ещё называют полярными. Аминокислоты с полярной боковой группировкой носят название гидрофильных, то есть «любящих воду». А «любовные связи» с водой они как раз и образуют своими полярными фрагментами — «плюс» притягивается к «минусу». Собственно, сами гидрофильные аминокислоты в одной и той же полипептидной цепи могут взаимодействовать друг с другом, притягиваться или отталкиваться, в зависимости от заряда полярной группы в боковой цепи. А есть аминокислоты, у которых нет такого сильного разделения заряда. Это аминокислоты гидрофобные — они «боятся» молекул воды и не горят желанием образовывать с ними связи, как, впрочем, и с другими полярными молекулами или ионами.
Для воды и других полярных молекул очень неудобно, когда посреди них вдруг возникает нечто, с чем они не могут взаимодействовать. Представьте, что посреди городской улицы вдруг выросла скала, которую нужно обходить, если вы хотите увидеть соседа или перейти из одного магазина в другой. Вот это самое «удобно/неудобно» на языке физики описывается термодинамическими уравнениями, которые определяют поведение и состояние молекулы белка в растворе с точки зрения энергии системы. У большой молекулы белка и у маленьких молекул воды, посреди которых она плавает, есть такие взаимные расположения или состояния, энергетически выгодные (удобные) и энергетически невыгодные (неудобные). Для положительно заряженной молекулы и отрицательно заряженной молекулы выгоднее сблизиться и образовать связь, пусть непрочную, чем сидеть поодиночке, а молекулам с одинаковым зарядом выгоднее сидеть подальше друг от друга. Поэтому полипептидная цепь никогда не выглядит как ровная палка — она всегда будет изогнутой и скрученной. Разнозаряженные гидрофильные аминокислоты в ней станут тянуться друг к другу, одинаково заряженные — отталкиваться, и к тем и другим будут тянуться молекулы воды.
Пептидами и полипептидами называют короткие цепочки из нескольких или нескольких десятков аминокислот, тогда как цепочки в белках обычно состоят из сотен аминокислот.
Последовательность двадцати аминокислот у разных белков может быть в чём-то похожей (особенно, если белки схожи по функциям и по эволюционной истории), но если брать последовательность аминокислот в целом, для каждого белка она индивидуальна, и даже по суммарному составу аминокислот разные белки порой сильно отличаются. Порядок аминокислот определяет функцию белка; мутации в ДНК, где закодирована аминокислотная последовательность белка, могут превратить белок в полностью нерабочую молекулу.
А что гидрофобные аминокислоты? С ними нужно что-то сделать, убрать с глаз долой, чтобы они не мешали заряженным молекулам сближаться или отталкиваться. Лучше спрятать их туда, где они не будут сталкиваться ни с водой, ни с заряженными аминокислотами. Полипептидную нитку можно свернуть в клубок, причём свернуть так, чтобы наружу глядели гидрофильные аминокислоты, а внутри сидели гидрофобные, поскольку они вполне хорошо переносят тесное соседство друг с другом. Тогда у молекулы белка в растворе получится энергетически выгодное состояние. В согнутой, скрученной цепи есть своё напряжение, повышающее энергию, но белку приходится с ним смириться, потому что это всё равно лучше, чем допустить гидрофобные аминокислоты смотреть в раствор и устроить «бунт на корабле».
