«Одноклеточная биология»
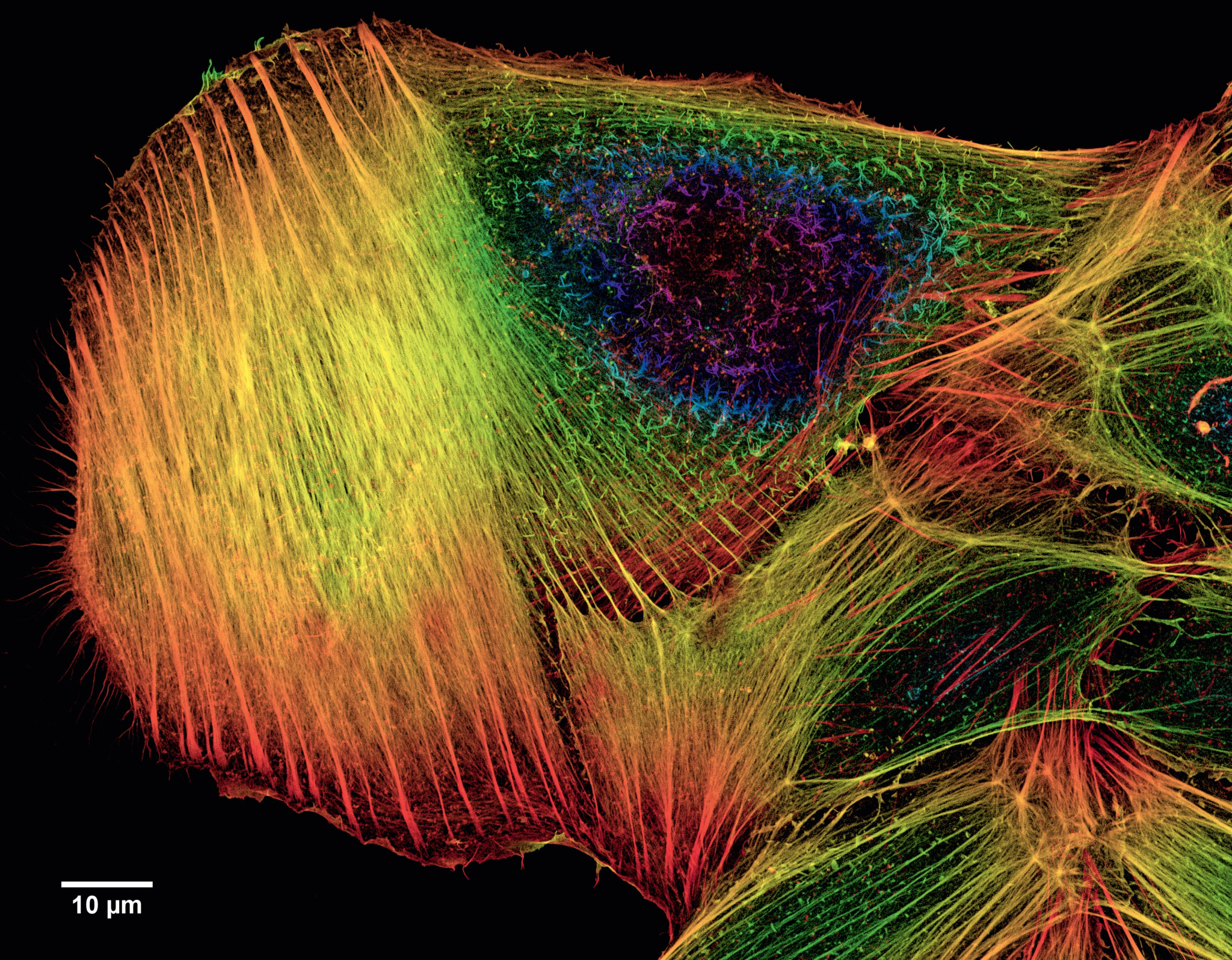
Все живые существа состоят из клеток, и клетки эти — разные. Клетки растений, грибов, клетки бактерий или клетки животных — все они отличаются друг от друга. Но и в каждом отдельном животном ведь не все же клетки одинаковы? Есть клетки кожи, клетки сердца, клетки печени и т. д. Заглянем ещё глубже и увидим, что в одном и том же органе клетки опять отличаются: в коже, например, есть слой эпидермиса, под ним — слой дермы, да и в самом эпидермисе различают несколько слоёв клеток. Достаточно посмотреть в микроскоп на клетки эпидермиса, чтобы увидеть, что они не копируют друг друга: там, где у одной клетки выступ, у другой окажется впадина.
Индивидуальные отличия между клетками можно найти не только в их внешнем виде, но и в биохимических реакциях, взаимодействиях между внутриклеточными молекулами, в активности генов. И ничего удивительного в этом нет. Например, все клетки так или иначе общаются с соседями с помощью биохимических сигналов. Кому-то сигнальных молекул достаётся больше, кому-то меньше — просто из-за особенностей расположения клетки в одном и том же органе. На разные сигналы или на разный уровень одного и того же сигнала клетки будут отвечать по-разному, пусть даже они относятся к одному и тому же виду.
Ещё можно вспомнить, что весь человеческий организм развивается из одной-единственной оплодотворённой яйцеклетки. Она делится, её дочерние клетки делятся, их дочерние клетки тоже делятся, и так много-много раз. При делении клетка удваивает (реплицирует) ДНК, а при синтезе ДНК в ней порой появляются ошибки — так уж устроен аппарат синтеза ДНК. Некоторые ошибки клетка устраняет, но некоторые так и остаются в наследство дочерней клетке и её потомкам. А ведь есть ещё мутации от внешних факторов, которые одна клетка опять же сумеет исправить, а другая — не сумеет. То есть у идентичных на вид клеток появляются отличия в геноме, которые можно обнаружить, только прочитав клеточную ДНК или проанализировав активность генов.
Если изучают общие свойства какой-нибудь ткани, индивидуальные отличия между клетками неважны. Все нейроны способны проводить импульс, все мышечные клетки могут сокращаться, и чтобы узнать, как они это делают, берут сразу очень много клеток — то есть в прямом смысле кусок ткани — и перетирают их, разрывают связи между ними, разрушают клеточные мембраны, а из образовавшегося «супа» вылавливают белки, нуклеиновые кислоты или какие-то продукты метаболизма. И если у двух-трёх-четырёх или даже ста клеток будут какие-то особенности в белках или нуклеиновых кислотах, на общем фоне этого не увидеть.
Но как быть, если надо изучить нечто, присущее именно отдельным клеткам? Возьмём, например, раковую опухоль: у злокачественных клеток есть много разных мутаций, какие-то мутации у них общие, но при этом опухоль в целом по мутационной картине может быть довольно разнообразной. Новые мутации, появившись у группы раковых клеток, могут защитить их от терапии, и тогда у больного, который как будто полностью избавился от опухоли, она через какое-то время появится снова. И чтобы лучше понимать, как развивается опухоль, хорошо бы уметь анализировать клетки поштучно.
Как отделить клетку от клетки
На самом деле наука уже давно изучает одиночные клетки — с тех пор, как стало возможным увидеть их в микроскоп. Но просто в микроскоп мы разглядим разве что какие-то особенности их строения. Микроскопия, безусловно, помогает сделать кое-какие выводы о том, как клетка живёт и работает. Однако это будет не полная картина.
Есть большой комплекс методов, позволяющих изучать физиологию отдельной клетки, — например, способность генерировать и проводить сигнал. Нейробиологи уже давно умеют изучать электрические свойства не просто одного-единственного нейрона, но и его отдельных отростков. Правда, это сравнительно обособленная область, и касается она только одного аспекта жизни клетки. В любом случае «электрические» особенности нейронов зависят от того, какие гены и когда у них включаются и какие белки в них содержатся.
Сейчас у биологов всё чаще возникает потребность получить молекулярный портрет индивидуальной клетки, причём желательно, чтобы этот портрет состоял не из одного-двух белков или генов, а из максимально полного их набора.
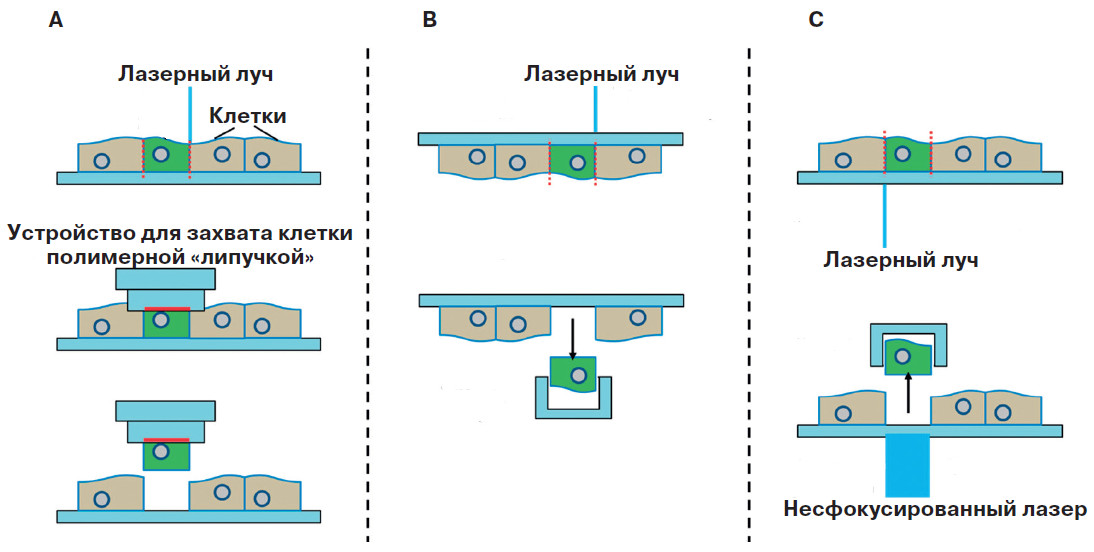
Чтобы иметь возможность изучать клетки по отдельности, необходимо решить целый ряд задач. Для начала нужно достать одну-единственную клетку из толщи ткани. Как это сделать? Например, нарезать ткань на тончайшие слои, чтобы отдельный срез был не толще нескольких десятков микрометров, и уже из одного такого среза вытащить нужную клетку. Её ищут под микроскопом, у которого есть лазерная установка, — именно лазер поможет отделить клетку от соседей. Лазерный «нож» достаточно тонок, чтобы не повредить ту клетку, которую выбрали.
Но как достать вырезанную клетку? Здесь приходит на помощь тот же лазер в виде лазерного пинцета: расфокусированный, чтобы не навредить клетке, пучок света выталкивает её из слоя давлением фотонов. Другой способ — дать вырезанной клетке упасть под действием силы тяжести. Наконец, есть ещё вариант, когда до вырезанной клетки дотрагиваются специальным легкоплавким полимером: его облучают инфракрасным светом, полимер размягчается и прилипает к клетке, а дальше остаётся только достать её.
Подобные манипуляции получили название лазерной захватывающей микродиссекции, хотя, может быть, удачнее было бы назвать это лазерной микродиссекцией с захватом (LCM, laser capture microdissection). Диссекция означает «препарирование», «рассечение», «разрез», но надо не просто разрезать и рассечь биологическую ткань, а одновременно захватить клетку, чтобы изучить её саму по себе, без соседей.
Можно обойтись без лазера, если оснастить микроскоп манипулятором с двумя микропипетками. Одна пипетка будет выдувать воздух, другая — всасывать. Глядя в микроскоп на срез ткани и управляя пипетками, нужную клетку в прямом смысле высасывают из ткани.
Если клетку извлекают с помощью микроманипуляции или лазерной диссекции, то чётко видно, откуда её достали. И это плюс. Но у микроманипуляции и диссекции есть один существенный минус — низкая пропускная способность. Иными словами, выковыривая клетки поштучно, много их не получишь. Поэтому, если требуется сразу много одиночных клеток, используют другие методы, в которых сначала создают клеточную суспензию (взвесь), механическими и химическими способами разрушая связи клеток друг с другом и с твёрдым субстратом, если они на нём сидели.
Клетки держит вместе межклеточное вещество или специальные соединительные белки, и разъединить их можно ферментами, которые осторожно разрушат крепёжные молекулы. Конечно, отделять клетки друг от друга нужно так, чтобы не повредить их мембраны.
Затем клеточную взвесь отправляют в микрофлюидное, или микропоточное, устройство, в котором клетки двигаются по очень тонким микрокапиллярам. Между стенками микрокапилляра может поместиться только одна клетка — значит, по капилляру они идут строго друг за другом.
Дальше могут быть разные варианты. Например, в микрокапилляре делают мембранные клапаны, которые то перегораживают капилляр, то открывают его. С помощью таких клапанов можно отделить клетки друг от друга. Не обязательно следить за ними напрямую: известно, что поперёк капилляра не может поместиться больше одной клетки, известен диаметр капилляра и скорость, с которой движется по нему жидкость с клетками, — значит, можно рассчитать частоту, с которой должны работать разделяющие клапаны.
Другой способ разделить клетки в системе капилляров — это смешать их с гидрофобной жидкостью. Капилляр, по которому идёт жидкость с клетками, пересекается с другим капилляром, по которому идёт гидрофобная жидкость — её можно назвать маслом. Масло делит жидкость с клетками на множество капель с одной-единственной клеткой в каждой капле. Затем эти шарики, окружённые маслом, отправляются в реакционные микроёмкости — в каждую ёмкость попадёт по одной капле с одной клеткой.
Ещё один вариант — движение потока жидкости с клетками над поверхностью с множеством впадинок-гнёзд. В каждом гнезде помещается только одна клетка; если какая-то одна попала в определённую впадинку, то другая клетка сюда уже не поместится и пойдёт дальше, до свободного гнезда. Так все клетки в суспензии сами распределяются по одиночным гнёздам.
Иначе сортируются клетки в методах, опирающихся на проточную цитометрию (см. статью «Управление полом», «Наука и жизнь» № 12, 2019 г.). Здесь жидкость с клетками течёт мимо специального датчика, отсчитывающего пробегающие перед ним клетки. Клетки выстраиваются в устройстве одна за другой благодаря так называемой гидродинамической фокусировке. В проточном канале есть внутренняя струя жидкости с клетками и внешняя, или струя-оболочка, которая бежит вплотную к стенкам канала, — за счёт особенностей гидродинамики одной и другой струи они не смешиваются, а клетки во внутренней струе начинают двигаться поодиночке. На шеренгу клеток падает луч лазера, который отмечает каждую клетку и попадает в фотоприёмник. Фотоприёмник может просто считать клетки — изначально проточную цитометрию для этого и придумали. Но потом появились модификации метода, позволяющие клетки не просто считать, но и сортировать. При сортировке клетки проходят через вибрирующий носик, который заключает каждую клетку в отдельную каплю жидкости. Если в капле находится клетка одного типа, то такой капле сообщают электрический заряд, после чего она проходит через электромагнитное поле, изменяющее движение заряженных частиц, и попадает в ёмкость для клеток своего типа. Если же в капле находится клетка другого типа, то каплю или не заряжают, или заряжают противоположным по знаку зарядом, и она попадает в другую ёмкость.
